Sistemas Homogéneos y Heterogéneos
La clasificación de los sistemas materiales en abiertos, cerrados y aislados, obedece a hechos observables en la superficie de contacto entre el sistema y el medio.
Si se atiende a las propiedades en el interior de cada sistema, se adopta otro criterio clasificador, según el cual hay dos posibilidades: sistemas homogéneos y sistemas heterogéneos.
Sistemas Homogéneos: si observamos las propiedades intensivas de una muestra de agua pura contenida en un recipiente (Punto de fusión, punto de ebullición, densidad, etc.), veremos que ellas permanecen constantes para cualquier porción de agua que se considere. El agua es el único componente del sistema.
Si ahora consideramos un sistema formado por el agua a la que le hemos agregado una pequeña cantidad de azúcar -sistema formado por dos componentes: agua y azúcar-, podemos observar y comprobar que las propiedades intensivas en este caso son iguales en todos los puntos de su masa.
Decimos entonces que, el sistema de un componente,agua pur, y el sistema de dos componentes, agua y azúcar, constituyen sistemas homogéneos.
Definimos sistema homogéneo: a aquel que presenta las mismas propiedades intensivas en todos sus puntos.Todo sistema homogéneo se caracteriza por presentar continuidad cuando se lo observa a simple vista, al microscopio y aún al ultramicroscopio. No es posible, en el ejemplo anterior, observar y distinguir el agua del azúcar.
Hay infinidad de sistemas homogéneos, entre otros: agua potable, aire (varios componentes); alcohol , agua (un componente), etc.

sistema homogéneo: agua pura
Un sistema homogéneo es, por ejemplo, la mezcla de sal común sobre una base de agua. La sal se disuelve en el agua de tal forma que es imposible verla a simple vista. El sistema constará de una sola fase y será homogéneo.
También el sistema homogéneo esta dividido en soluciones y substancias.
Las soluciones son cuando el sistema es homogéneo y tiene más de una substancia.Las soluciones están divididas en soluto y solvente.
Las substancias son cuando el sistema es homogéneo y tiene solo una substancia.

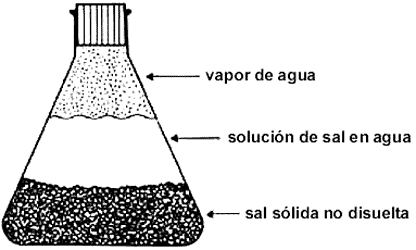
Sistemas Heterogéneos: si analizamos un sistema formado por agua y aceite (dos componentes), comprobamos que no posee homogeneidad, ya que a simple vista se distinguen la zona ocupada por el aceite y la zona ocupada por el agua. También podemos comprobar que ciertas propiedades intensivas (densidad por ejemplo) no se mantienen constantes cuando pasamos de un punto ocupado por el aceite a otro punto
ocupado por el agua. Lo mismo sucede en el sistema formado por agua líquida, hielo y vapor de agua -un componente.
Los sistemas anteriores son heterogéneos y los podemos definir como: aquellos sistemas que presentan distintas propiedades intensivas en por lo menos dos de sus puntos.
Otros ejemplos de sistemas heterogéneos son: agua y arena, agua y limaduras de hierro, pólvora (clorato de potasio, carbono y azufre), etc.
sistemas heterogéneos
Homogeneidad y heterogeneidad son conceptos relativos que dependen de las condiciones experimentales. Sangre humana y leche son sistemas homogéneos a simple vista, pero observados con un microscopio revelan heterogeneidad; en la sangre se observan glóbulos rojos diferenciados del suero y en la leche gotitas de grasa. En consecuencia todo depende de como se ha practicado la determinación y que instrumento se ha empleado.
Dado que son numerosos los instrumentos utilizados: lupa, microscopio óptico común, microscopio electrónico, equipo de rayos X, etc., se ha convenido lo siguiente: los sistemas homogéneos y heterogéneos serán establecidos mediante el microscopio óptico habitual en laboratorios químicos y biológicos, con este aparato se visualizan hasta 10-4 cm (0,0001 cm).
El granito es un ejemplo de sistema heterogéneo, al estar constituido por unos gránulos duros y semitransparentes, el cuarzo, unas partes más blandas y con un ligero tono rojizo, el feldespato, y unas manchas oscuras y brillantes que se exfolian con facilidad.
Gracias por tu atención y adiós.